Молекулярно-кинетическая теория рассматривает идеальный газ как множество частиц (молекул), расстояние между которыми намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения. Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц (молекул), из которых состоит газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр.
Такие параметры называются микроскопическими или микропараметрами.
Однако состояние газов можно охарактеризовать немногим числом физических величин, относящимся не к каждой молекуле, а ко всему газу в целом. Такие параметры называются макроскопическими или макропараметрами. Если состояние газа не меняется, то не меняются и эти параметры.
Поэтому температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа.
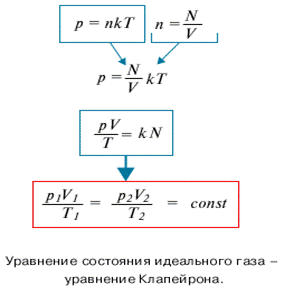
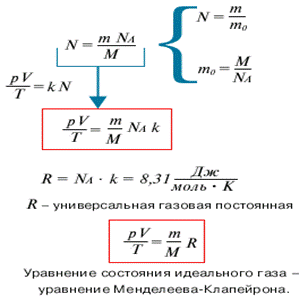
Из основного уравнения МКТ идеального газа можно получить уравнение состояния идеального газа, связывающее между собой параметры состояния Р, V и Т. Если исключить из уравнения МКТ микроскопический параметр - число частиц, - заменив его с помощью известных соотношений макроскопическим параметром - массой, то можно получить другую форму записи уравнения состояния:
Где величина m/M = N/Na= v - количество вещества. Наиболее принятая запись уравнения состояния идеального газа имеет вид pV = vRT.
О сайте|Разработчики
fizmatushki © 2019
e-mail:fizmatushki@yandex.ru