Термодинамика – это наука о тепловых явлениях. В противоположность молекулярно-кинетической теории, которая делает выводы на основе представлений о молекулярном строении вещества, термодинамика исходит из наиболее общих закономерностей тепловых процессов и свойств макроскопических систем. Выводы термодинамики опираются на совокупность опытных фактов и не зависят от наших знаний о внутреннем устройстве вещества, хотя в целом ряде случаев термодинамика использует молекулярно-кинетические модели для иллюстрации своих выводов.
Термодинамика рассматривает изолированные системы тел, находящиеся в состоянии термодинамического равновесия. Это означает, что в таких системах прекратились все наблюдаемые макроскопические процессы. Важным свойством термодинамически равновесной системы является выравнивание температуры всех ее частей.
Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное состояние. Такой переход называется термодинамическим процессом. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается близкой к равновесному состоянию. Процессы, состоящие из последовательности равновесных состояний, называются квазистатическими.
Одним из важнейших понятий термодинамики является внутренняя энергия тела. Все макроскопические тела обладают энергией, заключенной внутри самих тел. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества складывается из кинетической энергии всех атомов и молекул и потенциальной энергии их взаимодействия друг с другом. В частности, внутренняя энергия идеального газа равна сумме кинетических энергий всех частиц газа, находящихся в непрерывном и беспорядочном тепловом движении. Внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема (закон Джоуля).
Молекулярно-кинетическая теория приводит к следующему выражению для внутренней энергии одного моля идеального одноатомного газа (гелий, неон и др.), молекулы которого совершают только поступательное движение: $U = \dfrac{3}{2}N_A kT = \dfrac{3}{2}RT$. Для любого количества вещества формула внутренней энергии одноатомного газа будет иметь вид $U = \dfrac{3}{2} \nu RT = \dfrac{3}{2} \dfrac{m}{M}RT$, для двухатомного газа $U = \dfrac{5}{2} \nu RT = \dfrac{5}{2} \dfrac{m}{M}RT$ .Поскольку потенциальная энергия взаимодействия молекул реального газа зависит от расстояния между ними, в общем случае внутренняя энергия $U$ тела зависит наряду с температурой $T$ также и от объема $V$: $U = U(T, V)$.
Таким образом, внутренняя энергия $U$ тела однозначно определяется макроскопическими параметрами, характеризующими состояние тела $(p, V, T)$. Она не зависит от того, каким путем было реализовано данное состояние. Принято говорить, что внутренняя энергия является функцией состояния.
Внутренняя энергия тела может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ подвергается сжатию в цилиндре под поршнем, то внешние силы совершают над газом некоторую положительную работу $A'$. В то же время силы давления, действующие со стороны газа на поршень, приводят к расширению газа, т.е. сами совершают работу $A = –A'$.Если объем газа изменился на малую величину $\Delta V$, то газ совершает работу $A=pS\Delta x = p \Delta V$, где $p$ – давление газа, $S$ – площадь поршня, $\Delta x$ – его перемещение (рис. 1). При расширении работа, совершаемая газом, положительна, при сжатии – отрицательна. В общем случае при переходе из некоторого начального состояния (1) в конечное состояние (2) работа газа выражается формулой: $A = \sum_{i} p_i \Delta V_i$. На грфике представлен случай, когда работу по расширению совершает сам газ.
или $A=p \Delta V$ .
Работа численно равна площади под графиком процесса на диаграмме (p, V). Величина работы зависит от того, каким путем совершался переход из начального состояния в конечное. На следующем рисунке изображен график, на котором показаны примеры трёх переходов из состояния 1 в состояние2. Затем на трёх графиках каждый переход показан отдельно, это три различных процесса, переводящих газ из состояния (1) в состояние (2). Во всех трех случаях газ совершает различную работу.
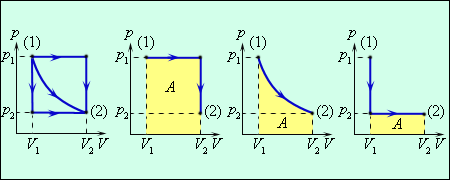
Первый процесс (второй график) состоит из изобары ($p_1$) и изохоры $A = p_1 (V_2 - V_1) = \nu R(T_2 - T_1)$.
Второй процесс (третий по счёту график) показывает что процесс протекает изотермически, в этом случае работа определяется как интеграл $A = \int_{V_1}^{V_2} p \Delta V$.
Третий процесс (четвёртый, последний график) состоит из изохоры и изобары ($p_2$) $A = p_2 {V_2 - V_1} = \nu R (T_3 - T_4)$.
Внутренняя энергия тела может изменяться не только в результате совершаемой работы, но и вследствие теплообмена. При тепловом контакте тел внутренняя энергия одного из них может увеличиваться, а внутренняя энергия другого – уменьшаться. В этом случае говорят о тепловом потоке от одного тела к другому. Количеством теплоты $Q$, полученной телом, называют изменение внутренней энергии тела в результате теплообмена.
Передача энергии от одного тела другому в форме тепла может происходить только при наличии разности температур между ними.
Тепловой поток всегда направлен от горячего тела к холодному.
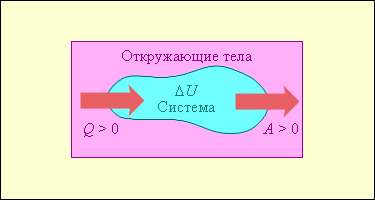
Количество теплоты $Q$ является энергетической величиной. В СИ количество теплоты измеряется в единицах механической работы – джоулях (Дж).На рисунке условно изображены энергетические потоки между выделенной термодинамической системой и окружающими телами. Величина $Q > 0$, если тепловой поток направлен в сторону термодинамической системы. Величина $A > 0$, если система совершает положительную работу над окружающими телами.
Если система обменивается теплом с окружающими телами и совершает работу (положительную или отрицательную), то изменяется состояние системы, то есть изменяются ее макроскопические параметры (температура, давление, объем). Так как внутренняя энергия $U$ однозначно определяется макроскопическими параметрами, характеризующими состояние системы, то отсюда следует, что процессы теплообмена и совершения работы сопровождаются изменением $\Delta U$ внутренней энергии системы.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение $\Delta U$ внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты $Q$, переданной системе, и работой $A$, совершенной системой над внешними телами $\Delta U = Q – A$. В этой формуле$Q$ - это количество теплоты, которое получает система (тело) из внешней среды, а $А$ - это работа, которую совершает сама система ( само тело). Если система будет отдавать тепло во внешнюю среду, то перед $Q$ ставится знак "-". Если над системой бедет совершенароабота то перед $A$ ставится знак "+".
Первый закон термодинамики часто записывают в другой форме: $Q = \Delta U + A$.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы самой системой (газом) над внешними телами.
В формуле первого закона термодинамики $A = p \Delta V = \nu R \Delta V = \dfrac{m}{M} R \Delta N$, где $\nu$ – количество вещества, $M$ – молярная масса вещества.
$\Delta U = \dfrac{3}{2} \dfrac{m}{M} R \Delta T = \dfrac{3}{2} p \Delta V$ (для изобары) или $\Delta U = \dfrac{3}{2} \dfrac{m}{M} R \Delta T = \dfrac{3}{2} \Delta p V$ (для изохоры).
Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Важным следствием первого закона термодинамики является утверждение о невозможности создания машины, способной совершать полезную работу без потребления энергии извне и без каких-либо изменений внутри самой машины. Такая гипотетическая машина получила название вечного двигателя (perpetuum mobile) первого рода. Многочисленные попытки создать такую машину неизменно заканчивались провалом. Любая машина может совершать положительную работу $A$ над внешними телами только за счет получения некоторого количества теплоты $Q$ от окружающих тел или уменьшения $\Delta U$ своей внутренней энергии.
Применим первый закон термодинамики к изопроцессам в газах.
1. В изохорном процессе ($V = cons$t) газ работы не совершает, $A = 0$. Следовательно, $Q = \Delta U = U(T_2) – U(T_1)$. Здесь $U(T_1)$ и $U(T_2)$ – внутренние энергии газа в начальном и конечном состояниях. Внутренняя энергия идеального газа зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом ($Q > 0$), и его внутренняя энергия увеличивается. При охлаждении тепло отдается внешним телам ($Q < 0$).$Q = \Delta U =\dfrac{3}{2} \dfrac{m}{M}R\Delta T$ для одноатомного газа и $Q = \Delta U =\dfrac{5}{2} \dfrac{m}{M}R\Delta T$ для двухатомного.
2. В изобарном процессе ($p= const$) работа, совершаемая газом, выражается соотношением $A = p(V_2 – V_1) = p \Delta V$. Первый закон термодинамики для изобарного процесса дает: $Q = U(T_2) – U(T_1) + p(V_2 – V_1) = \Delta U + p\Delta V$, или$Q = A + \Delta U = \dfrac{5}{2} \dfrac{m}{M}R\Delta T$ для одноатомного газа и $Q = \Delta U = \dfrac{7}{2} \dfrac{m}{M}R\Delta T$ для двухатомного.
При изобарном расширении $Q > 0$ – тепло поглощается газом, и газ совершает положительную работу. При изобарном сжатии $Q < 0$ – тепло отдается внешним телам. В этом случае $A < 0$. Температура газа при изобарном сжатии уменьшается, $T_2 < T_1$; внутренняя энергия убывает, $\Delta U < 0$.
3. В изотермическом процессе ($T = const$, температура газа не изменяется, следовательно, не изменяется и внутренняя энергия газа, $\Delta U = 0$).
Первый закон термодинамики для изотермического процесса выражается соотношением
$Q = A$, где $A = \int_{V_1}^{V_2} p \Delta V$.
Количество теплоты $Q$, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называются адиабатическими.
В адиабатическом процессе $Q = 0$; поэтому первый закон термодинамики принимает вид $A = –\Delta U$, то есть газ совершает работу за счет убыли его внутренней энергии.На плоскости (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При адиабатическом расширении газ совершает положительную работу $(A > 0)$; поэтому его внутренняя энергия уменьшается $(\Delta U < 0)$. Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатическом расширении убывает быстрее, чем при изотермическом расширении.
Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
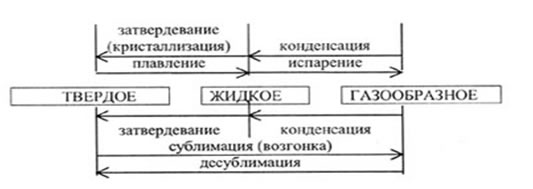
Теплопередачей называется процесс перехода внутренней энергии от одного тела к другому без совершения над телом работы Виды теплопередачи: конвекция; теплопроводность; лучеиспускание. Конвекция - процесс передачи количества теплоты путем перемешивания холодных и теплых слоев жидкости или газа (центральное водяное отопление, ветры, морские течения, тяга в трубах, нагревание жидкости снизу сосуда). Теплопроводность - процесс передачи количества теплоты от более нагретой части тела к менее нагретой без перемещения частиц (металлы - хорошие проводники тепла; дерево, стекло, кожа - плохие; газы менее теплопроводны, чем жидкость $\Rightarrow$ плохая теплопроводность. Лучеиспускание — теплопередача через излучение с помощью электромагнитных волн (энергия, получаемая Землей от Солнца ) Количество теплоты $Q$ - количество энергии, переданной от тела телу в результате теплопередачи (без совершения работы). Фаза - физически однородная часть вещества, отделенная от остальных частей системы границей раздела (лед, вода, пар). Фазовый переход - переход из одной фазы в другую, из одного агрегатного состояния в другое.
Рассмотрим формулы, которые позволят рассчитать количество теплоты для нагревания и охлаждения тела: $Q = cm(t_2 - t_1)$, где $с$ - удельная теплоемкость, $C = mc$ - теплоёмкость.
$Q = \lambda m$ - количество теплоты для плавления и отвердевания тела, где $\lambda$ - удельная теплота плавления
$Q = mL$ - количество теплоты для парообразования и конденсации тела, где $L$ - удельная теплота парообразования.
$Q = mq$ - количество теплоты, выделенное при сгорании топлива.Точка, или температура плавления, - температура, при которой плавится (или отвердевает) кристаллическое тело при постоянном давлении. Аморфные тела (стекло, воск, парафин, вар) не имеют точки плавления.
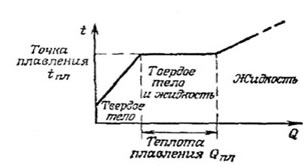
На графике приведён пример передачи тепла твёрдому телу, которое сначала нагревают до температуры плавления, затем плавят и полученное жидкое тело нагревают.
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты $Q$, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоёмкостью тела $c$, которую можновычислить по формуле, но для каждого вещества это табличная величина:
$c = \dfrac{Q}{m(t_2-t_1)} \left ( \dfrac{Дж}{^o C \cdot кг}\right )$ Во многих случаях удобно использовать молярную теплоемкость $C_{\mu}$: $C_{\mu} = M \cdot c$, где $M$– молярная масса вещества.
$\lambda = \dfrac{Q}{m} \left ( \dfrac{Дж}{кг}\right )$ - удельная теплота плавления (отвердевания).
$L = \dfrac{Q}{m} \left ( \dfrac{Дж}{кг}\right )$- удельная теплота парообразования (конденсации).
Если тепловую энергию отдают одни тела, а берут её другие тела, то согласно закону сохранения энергии Сколько тепловой энергии тела отдают, столько другие тела берут:
$Q_1+Q_2+... = Q_3 + Q_4 + ...$ - это уравнение теплового балланса
(слева сумма всех энергий, которые тела отдают, справа - сумма энергий, которые тела берут).
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
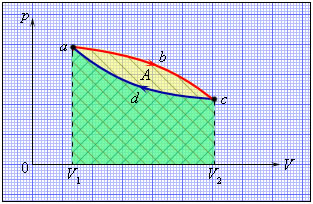
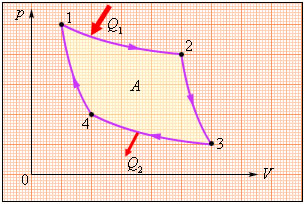
Как следует из первого закона термодинамики, полученное газом количество теплоты $Q$ полностью превращается в работу $A$ при изотермическом процессе, при котором внутренняя энергия остается неизменной ($\Delta U = 0$): $A = Q$Но такой однократный акт преобразования теплоты в работу не представляет интереса для техники. Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т. д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние. Круговые процессы изображаются на диаграмме (p, V) газообразного рабочего тела с помощью замкнутых кривых (рис.). При расширении газ совершает положительную работу A1, равную площади под кривой abc, при сжатии газ совершает отрицательную работу A2, равную по модулю площади под кривой cda. Полная работа за цикл A = A1 + A2 на диаграмме (p, V) равна площади цикла. Работа A положительна, если цикл обходится по часовой стрелке, и A отрицательна, если цикл обходится в противоположном направлении.
Круговой процесс на диаграмме (p, V). abc – кривая расширения, cda – кривая сжатия. Работа A в круговом процессе равна площади фигуры abcd.
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты $Q_1 > 0$ и отдает холодильнику количество теплоты $Q_2 < 0$. Полное количество теплоты $Q$, полученное рабочим телом за цикл, равно
$Q = Q_1 + Q_2 = Q_1 – |Q_2|$
При обходе цикла рабочее тело возвращается в первоначальное состояние, следовательно, изменение его внутренней энергии равно нулю ($\Delta U = 0$). Согласно первому закону термодинамики,$\Delta U = Q - A = 0$
Отсюда следует: $A = Q = Q_1 – |Q_2|$.
Работа $A$, совершаемая рабочим телом за цикл, равна полученному за цикл количеству теплоты $Q$. Отношение работы $A$ к количеству теплоты $Q_1$, полученному рабочим телом за цикл от нагревателя, называется коэффициентом полезного действия $\eta$ тепловой машины:
$\eta = \dfrac{A}{Q_1} = \dfrac{Q_1 - |Q_2|}{Q_1}$, где $Q_1$ - теплота от нагревателя, $Q_2$ - теплота холодильника, $A$ - полезная работа, которую совершает газ.
В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат. Этот круговой процесс сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно
По определению, коэффициент полезного действия $\eta$ цикла Карно есть
$\eta = \dfrac{A}{Q_1} = \dfrac{A_{12} + A_{34}}{Q_1} = \dfrac{Q_1 - |Q_2|}{Q_1} = 1 - \dfrac{|Q_2|}{Q_1}$ Данная формула справедлива для реальных и идеальных газов.
С. Карно выразил коэффициент полезного действия цикла через температуры нагревателя $T_1$ и холодильника $T_2$:
$\eta = \dfrac{T_1-T_2}{T_1} = 1 - \dfrac{T_2}{T_1}$Данная формула справедлива только для идеальных газов.
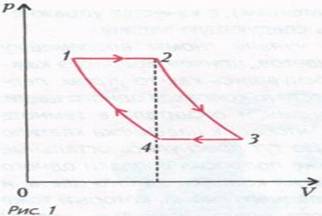
Задача 1. На диаграмме зависимости давления $p$ от объема $V$ для некоторой массы идеального газа две изотермы пересекаются двумя изобарами в точках 1, 2, 3 и 4 (рис. 1). Найдите отношение температур $\dfrac{T_3}{T_1}$ в точках 3 и 1, если отношение объемов в этих точках $\dfrac{V_3}{V_1} = \alpha$. Объемы газа в точках 2 и 4 равны.
Рассмотрим изобарические участки. Уравнение изобары имеет вид $\dfrac{V}{T} = const$.
Для состояний 1 и 2, и для состояний 3,4 имеем $\dfrac{V_1}{T_1} = \dfrac{V_2}{T_2}$, где $T_1$ и $T_2$ – температуры газа на изотермах 4 – 1 и 2 – 3, а $V_1$ и $V_2$ – объемы газа в состояниях 1 и 2. Аналогичное соотношение для состояний 3 и 4 буд ет иметь вид $\dfrac{V_3}{T_3} = \dfrac{V_4}{T_1}$, где $V_3$ и $V_4$ – объемы газа в состояниях 3 и 4. Добавим два очевидных соотношения и получим следующую систему уравнений:
$\left\{\begin{matrix}
V_2 = V_4\\
\dfrac{V_3}{V_1} = \alpha\\
\dfrac{V_1}{T_1} = \dfrac{V_2}{T_2}\\
\dfrac{V_3}{T_3} = \dfrac{V_4}{T_1}\\
\end{matrix}\right.$
Решать систему уравнений можноразличными способами, но удобно из третьего и четвертого уравнений выразить отношение $\dfrac{T_3}{T_1}$ и равное ему $\dfrac{T_2}{T_1}$, перемножить почленно и получить
$\left ( \dfrac{T_3}{T_1} \right ) ^2 = \dfrac{V_3}{V_1} = \alpha \Rightarrow \dfrac{T_3}{T_1} = \sqrt{\alpha}$.Задача 2. На рисунке 2 для n молей гелия показан цикл, состоящий из двух участков линейной зависимости давления $p$ от объема $V$ и изобары. На изобаре 1–2 газ совершил работу $A$, и его температура увеличилась в 4 раза. Температуры в состояниях 1 и 3 равны. Точки 2 и 3 на $pV$-диаграмме лежат на прямой, проходящей через начало координат. Определите температуру газа в точке 1. Определите также работу газа за цикл.
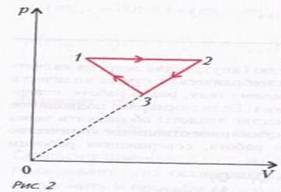
Обозначим температуру гелия в состоянии 1 через $T_1$, тогда температура в состоянии 2 будет равна $4T_1$. Пусть давление на изобаре 1-2 равно $p_1$, тогда работа, которую совершил газ при изобарическом процессе, равна $A = p_1(V_2 - V_1)$, где $V_1$ и $V_2$ – объемы гелия в состояниях 1 и 2. Поскольку $p_1 V_1 = \nu RT_1$ и $p_1 V_2 = 4\nu RT_1$, то $A = 3 \nu RT_1$. Отсюда $T_1 = \dfrac{A}{3 \nu R}$. Работу газа за цикл вычислим по площади треугольника 123: $A_{123} = \dfrac{1}{2} (p_1 - p_3)(V_2 - V_1)$, где $p_3$ – давление газа в состоянии 3. Из уравнения состояния для идеального газа найдем $V_1 = \dfrac{\nu RT_1}{p_1} = \dfrac{A}{3p_1}$ и $\dfrac{4 \nu RT_1}{p_1} = \dfrac{4A}{3p_1}$.
После подстановки значений $V_1$ и $V_2$ в выражение для работы газа за цикл получим $A_{123} = \dfrac{A}{2} \left ( 1 - \dfrac{p_3}{p_1} \right )$. Так как на нашей pV-диаграмме точки 2 и 3 лежат на прямой, проходящей через начало координат, можно записать соотношение $\dfrac{p_3}{p_1} = \dfrac{V_3}{V_2}$.
Поскольку $V_3 = \dfrac{\nu RT_1}{p_3} = \dfrac{A}{3p_3}$ и $V_2 = \dfrac{4A}{3p_1} \Rightarrow \dfrac{p_3}{p_1} = \dfrac{p_1}{4p_3} \Rightarrow \dfrac{p_3}{p_1} = \dfrac{1}{2}$.
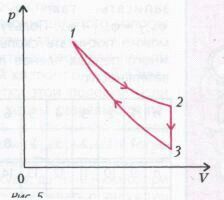
и окончательно $A_{123} = \dfrac{A}{4}$.Задача 3. КПД тепловой машины, работающей по циклу, состоящему из изотермы 1-2, изохоры 2-3 и адиабатического процесса 3-1 (рис. 5), равен $h$, а разность максимальной и минимальной температур газа в цикле равна $\Delta Т$. Найдите работу, совершенную n молями идеального одноатомного газа в изотермическом процессе.
Нам задан КПД цикла, поэтому сначала разберемся, на каких участках цикла тепло подводится к газу, а на каких отводится.
На изотермическом участке 1-2 газ совершает работу (происходит увеличение объема), а поскольку внутренняя энергия газа не изменяется (почему?), то работа газа совершается за счет подвода тепла. Обозначим подведенное количество тепла через $Q_1$.
На изохоре 2-3 при постоянном объеме происходит падение давления. Очевидно, что это осуществляется за счет уменьшения температуры газа, и в этом случае тепло отводится от газа. Обозначим отведенное количество тепла через $Q_2$.
На адиабатическом участке 3-1 не отводится и не подводится, а с уменьшением объема над газом совершается работа, и его температура растет.
Следовательно, в точке 3 газ имеет наименьшую температуру $T_{min}$, а максимальная температура $T_{max}$ газа была на изотерме 1-2. Таким образом,$T_{max} - T_{min} = \Delta T$
Поскольку речь идет о КПД, запишем определение КПД замкнутого цикла: $\eta = \dfrac{Q_1 - Q_2}{Q_1} = 1 - \dfrac{Q_2}{Q_1}$
На изотермическом участке $Q_1 = A$. Тепло $Q_2$ равно изменению внутренней энергии газа на участке 2-3, взятому с обратным знаком (это тепловая энергия, отданная холодильнику): $Q_2 = \dfrac{3}{2} \nu R(T_{max} - T_{min}) = \dfrac{3}{2} \nu R \Delta T$.
Решив эту системувышерассмотренных уравнений, получим $A = \dfrac{3 \nu R \Delta T}{2(1-\eta)}$.
О сайте|Разработчики
fizmatushki © 2019
e-mail:fizmatushki@yandex.ru