Известно, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг относительно друга на расстояниях, существенно превышающих их собственные размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше энергии межмолекулярного взаимодействия. Для выяснения наиболее общих свойств, присущих всем газам, используют упрощенную модель реальных газов - идеальный газ. Основные отличия идеального газа от реального газа:
1. Частицы идеального газа - сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
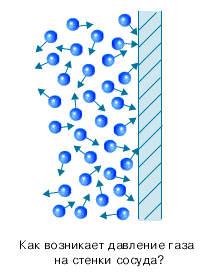
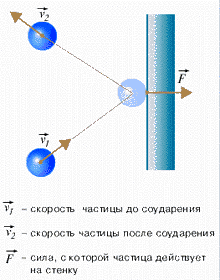
3. Соударения частиц являются абсолютно упругими. Реальные разреженные газы действительно ведут себя подобно идеальному газу.Воспользуемся моделью идеального газа для объяснения происхождения давления газа. Вследствие теплового движения, частицы газа время от времени ударяются о стенки сосуда. При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку. Понятно, что чем больше частиц содержится в сосуде, тем чаще они будут ударяться о стенку сосуда, и тем большей будет сила давления, а значит и давление. Чем быстрее движутся частицы, тем сильнее они ударяют в стенку сосуда. Мысленно представим себе простейший опыт: катящийся мяч ударяется о стенку. Если мяч катится медленно, то он при ударе подействует на стенку с меньшей силой, чем если бы он двигался быстро. Чем больше масса частицы, тем больше сила удара. Чем быстрее движутся частицы, тем чаще они ударяются о стенки сосуда. Итак, сила, с которой молекулы действуют на стенку сосуда, прямо пропорциональна числу молекул, содержащихся в единице объема (это число называется концентрацией молекул и обозначается n), массе молекулы mo, среднему квадрату их скоростей и площади стенки сосуда. В результате получаем: давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы (или их кинетической энергии). Зависимость давления идеального газа от концентрации и от средней кинетической энергии частиц выражается основным уравнением молекулярно-кинетической теории идеального газа. Мы получили основное уравнение МКТ идеального газа из общих соображений, но его можно строго вывести, опираясь на законы классической механики. Приведем одну из форм записи основного уравнения МКТ: $p = \dfrac{1}{3} m_0 n \vartheta^2$, где $m_0$ - масса одной частицы, $n$ - концентрация частиц, $\vartheta^2$ - квадрат средней скорости движения частиц в веществе.
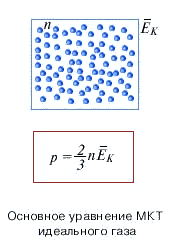
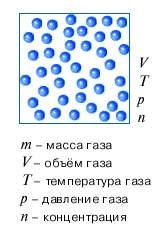
Пусть в каком-то сосуде объёмом $V$ при иемпературе $T$ содержится некоторое количество газа массой $m$ и молярной массой $M$. Газ даёт на стенки сосуда давление $p$, где давление можно высчитать по формуле $p = \dfrac{1}{3} m_0 n \vartheta^2$. Если заменить произведение массы и квадрата скорости на $E_{kin} = \dfrac{m_0 \vartheta^2}{2}$ кинетическую энергию, то получим ещё один вид основного уравнения молекулярно-кинетической теории идеального газа $p = \dfrac{2}{3} n E_{kin}$. Кроме этого преобразования можно получить ещё ряд формул, которые приведены на рисунке справа.

О сайте|Разработчики
fizmatushki © 2019
e-mail:fizmatushki@yandex.ru