1 положение МКТ: Все вещества и тела в природе состоят из отдельных атомов или молекул - групп атомов. Такие большие тела называются макроскопическими. Атомы и молекулы относятся к микроскопическим телам. О том, что все вещества и тела состоят из мельчайших неделимых частиц догадывались ещё древнегреческие философы Демокрит и Левкипп. Теперь эти догадки являются установленными фактами. Современные приборы (ионные проекторы, туннельные микроскопы) позволяют видеть изображения отдельных атомов и молекул.
Основа строения вещества - атомы. Атомы тоже имеют сложную структуру, они состоят из элементарных частиц - протонов, нейтронов, входящих в состав ядра атома, электронов, а также других элементарных частиц.
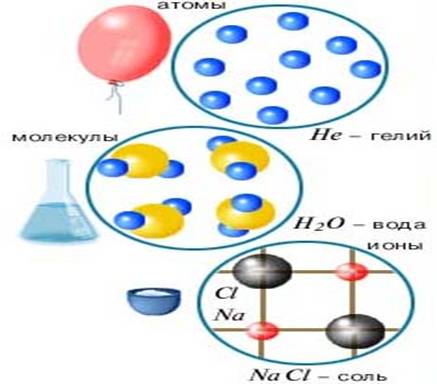
Атомы могут объединяться в молекулы, а могут быть вещества, состоящие только из атомов. Атомы в целом электронейтральны. Атомы, имеющие избыток или недостаток электронов называются ионами. Бывают положительные и отрицательные ионы. Атомы могут находиться в состоянии ионов. Есть вещества, состоящие из ионов. На иллюстрации показаны примеры разных веществ, имеющих строение соответственно в виде атомов, молекул и ионов.
2 положение МКТ: Атомы и молекулы находятся в постоянном, непрерывном беспорядочном (хаотичном) движении, такое движение называют тепловым движением, потому что скорость движения частиц увеличивается с ростом температуры. Экспериментальным подтверждением непрерывного движения атомов и молекул в веществе является броуновское движение и диффузия. Молекулы в газе движутся хаотично (беспорядочно). В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Молекулы в газе движутся с большими скоростями (сотни м/с).
3 положение МКТ: Атомы и молекулы вещества находятся в постоянном взаимодействии: притяжении, отталкивании и столкновении. Сталкиваясь, они отскакивают друг от друга как абсолютно упругие шарики, изменяя величину и направление скоростей. При больших расстояниях между молекулами силы притяжения малы и не способны удержать молекулы газа друг возле друга. Поэтому газы могут неограниченно расширяться. Газы легко сжимаются, среднее расстояние между молекулами при этом уменьшается, но все равно остается большим их размеров. Газы не сохраняют ни формы, ни объема, их объем и форма совпадают с объемом и формой сосуда, который они заполняют. Многочисленные удары молекул о стенки сосуда создают давление газа. Молекулы жидкости расположены почти вплотную друг к другу. Поэтому жидкости очень плохо сжимаются и сохраняют свой объем. Молекулы жидкости совершают колебания около положения равновесия. Время от времени молекула совершает переходы из одного оседлого состояния в другое, как правило, в направлении действия внешней силы. Время оседлого состояния молекулы мало и с ростом температуры уменьшается, а время перехода молекулы в новое оседлое состояние еще меньше. Поэтому жидкости текучи, не сохраняют своей формы и принимают форму сосуда, в который налиты. Теория жидкого состояния вещества впервые была разработана крупным советским физиком-теоретиком Я.И. Френкелем. Броуновское движение - это тепловое движение мельчайших частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Броуном (1827 г.) и явилось наглядным доказательством хаотичного молекулярного движения. Броуновские частицы движутся под влиянием ударов молекул. Из-за хаотичности теплового движения молекул, эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по величине и направлению, а ее траектория представляет собой сложную зигзагообразную линию. Молекулярно-кинетическая теория броуновского движения была создана А.Эйнштейном (1905 г.).
Согласно основным положениям МКТ все тела состоят из молекул (или атомов); между молеклами на малых расстояниях (меньших размеров молекул) действуют силы отталкивания, а на больших - силы притяжения; молекулы участвуют в хаотичном тепловом движении.
Массы молекул малы, а число их в макроскопических телах огромно. Поэтому вместо абсолютных значений масс молекул и их количества вещества в макроскопических телах используют относительные величины. Относительной молекулярной (или атомной) массой называют отношение массы молекулы (или атома) к 1/12 массы атома углерода.$M_r = \dfrac{m_0}{\dfrac{1}{12}m_{0_C}}$.
Количество вещества выражается в молях. Моль - количество вещества, содержащее столько же молекул, сколько содержиться атомов в 0,012 кг углерода.
Число молекул в моле вещества называют постоянной Авогадро: $N_a = 6 \cdot 10^{23}$ моль-1.
Количество вещества равно отношению числа молекул N в теле к постоянной Авогадро. $\nu = \dfrac{N}{N_a}$
Молярной массой называют массу вещества, взятого в количестве одного моля. $M=m_0N_a$.
В газах расстояние между молекулами во много раз больше размеров последних. В жидкостях и твердых телах молекул (или атомы) находятся непосредственно друг возле друга. В твердых телах атомы (или молекулы) расположены в строгом порядке и совершают колебания около неизменных положений равновесия. В жидкостях молекулы расположены неупорядоченно и время от времени совершают перескоки из одного положения равновесия в другое.В МКТ идеальным газом называют газ, состоящий из молекул, взамимодействием которых можно пренебречь.
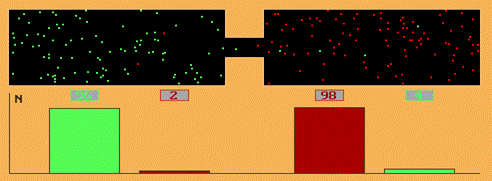
Явление самопроизвольного проникновения частиц одного вещества в другое вещество принято называть диффузией. При этом вещества перемешиваются. Почему же газы или жидкости перемешиваются, хотя их никто специально не перемешивает? Это можно объяснить, если вспомнить, что все вещества состоят из частиц, и между частицами есть промежутки. Раз газы или жидкости перемешиваются сами собой, значит частицы вещества все время движутся, движутся беспорядочно, во всех направлениях. Это движение частиц и есть причина перемешивания двух веществ. Диффузией также называется процесс самопроизвольного выравнивания концентраций молекул жидкости или газа в различных частях объема. Диффузия стремится приблизить систему к состоянию термодинамического равновесия. Если в двух половинках сосуда находятся разные газы (при одинаковых температурах и давлениях) и между ними нет разделяющей перегородки, то вследствие теплового движения молекул возникает процесс взаимопроникновения газов. Этот процесс и называется диффузией. Скорость диффузии сильно зависит от длины свободного пробега молекул, то есть от среднего paccтoяния, которое пролетают молекулы между двумя последовательными соударениями с другими молекулами. Диффузия может происходить не только в газах, но и в жидкостях, и в твердых телах. Причем, диффузия газов происходит очень быстро, а диффузия твердых тел очень медленно. Опыты показывают: чем выше температура, тем диффузия происходит быстрее. Мы ощущаем запахи, благодаря диффузии пахучего вещества в воздухе.
Диффузия (начало процесса).
Диффузия (установившееся положение).
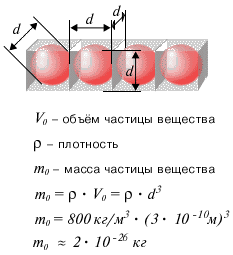
Свойства и поведение тел, в процессах передачи и превращения энергии, определяются движением взаимодействующих друг с другом частиц, из которых состоит тело: атомов, молекул и ионов. Каков размер этих частиц? Как его измерить? Если высыпать горошины из стакана на стол, то толщина образованного ими на столе слоя окажется равной диаметру горошины. Подобный способ можно использовать для определения размеров частиц вещества. Конечно же, реальная форма частиц вещества не шарообразная, а гораздо более сложная. Но указанный способ позволяет, с известной точностью, оценить размеры частиц вещества. Частицы в жидкости располагаются достаточно плотно (см. рисунок ниже).
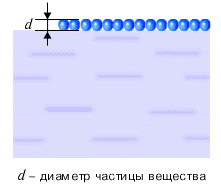
Можно считать, что на каждую частицу вещества приходится объем, равный объему куба, сторона которого равна диаметру частицы. Тогда, зная плотность жидкости и диаметр частицы вещества, а стало быть, и объем частицы, можно оценить массу частицы вещества. Оценки размера и массы молекулы сделаны ниже на рисунках для капли нефти.

Оценка размеров молекул (атомов)
Оценка массы молекулы (атома)В силу того, что массы частиц вещества крайне малы, удобно пользоваться не абсолютными, а относительными единицами массы. Для этого используется так называемая атомная единица массы (а.е.м.), равная 1/12 массы атома углерода. Массу частицы, измеренную в а.е.м. принято называть относительной атомной (или молекулярной) массой. Значения относительных атомных масс приведены в периодической системе химических элементов Д.И. Менделеева. Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих данную молекулу. Экспериментально установлено, что 1 а.е.м. = 1,66· 10-27 кг. В Международной системе СИ для измерения количества вещества ($\nu$) введена специальная единица - моль. 1 моль - это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода. Постоянная Авогадро численно равна количеству частиц, содержащихся в 1 моле любого вещества: $N_a = 6 \cdot 10^{23}$моль-1. Масса 1 моля вещества называется молярной массой ($M$). Численное значение молярной массы, выраженной в г/моль, равно значению относительной атомной или молекулярной массы. Количество вещества, постоянная Авогадро, молярная масса, масса молекулы - эти величины связаны между собой соотношениями, которые приведены ниже на рисунках. Часто при решении той или иной задачи важнее знать не число частиц вещества, а их концентрацию. Концентрация ($n$) показывает, сколько частиц содержится в единице объема (чаще всего - в одном кубическом метре) данного вещества. Ниже на рисунках приведены формулы для массы молекулы mo, молярной массы $M$, количества вещества $\nu$, числа молекул $N$ и концентрации молекул $n$. ($V$ - объем вещества).
$M = m_0 \cdot N_A$
$m = m_0 \cdot N$
$\nu = \dfrac{m}{M} = \dfrac{N}{N_A}$
$N = N_A \cdot \nu = N_A \dfrac{m}{M}$$M = \dfrac{m}{\nu}$
$M$ - молярная масса
$[M]$ = кг/моль
$m_0=\dfrac{m}{N} = \dfrac{m}{\nu N_A} = \dfrac{M}{N_A}$
$M = m_0 N_A$$n$ - концентрация
$n = \dfrac{N}{V}$
$[n] = \dfrac{1}{м^3} = м^{-3}$
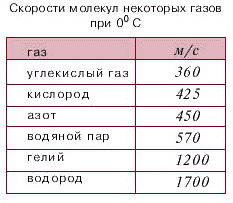
В 1920 году физиком Отто Штерном (1888-1969) впервые были экспериментально определены скорости частиц вещества. Прибор Штерна состоял из двух цилиндров разных радиусов, закрепленных на одной оси. Воздух из цилиндров был откачан до глубокого вакуума. Вдоль оси натягивалась платиновая нить, покрытая тонким слоем серебра. При пропускании по нити электрического тока она нагревалась до высокой температуры, и серебро с ее поверхности испарялось. В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проникали движущиеся атомы металла, осаждаясь на внутренней поверхности внешнего цилиндра, образуя хорошо наблюдаемую полоску. Цилиндры начинали вращать с постоянной угловой скоростью. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол. Зная величины радиусов цилиндров, скорость их вращения и величину смещения, легко найти скорость движения атомов. Если бы все атомы двигались с одинаковой скоростью, то при вращении установки полоска на стенке внешнего цилиндра получалась бы точно такой же тонкой, как и в случае, когда установка не вращалась. Однако при вращении полоска, образованная осевшими на стенку цилиндра атомами, оказывалась размытой. Значит скорости атомов были разными.
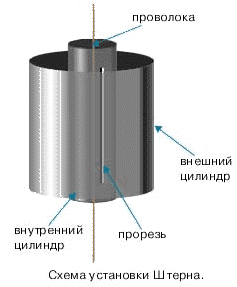
, где $\vartheta$ - скорость атомов серебра в опыте Штерна. Но в любом веществе из-за столкновений атомы движуться с разными скоростями, поэтому существует скорость, около значений которой находятся скорости, с которыми движется наибольшее число молекул. Эта скорость называется наиболее вероятной скоростью $\vartheta_B$: $\vartheta_B=\sqrt{\dfrac{2RT}{M}}$. Она отличается от значения средней квадратичной скорости.
О сайте|Разработчики
fizmatushki © 2019
e-mail:fizmatushki@yandex.ru