С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из параметров - давление, объем или температура - остается постоянным, а изменяются только остальные два и получить теоретически газовые законы для этих условий изменения состояния газа.
Такие процессы называют изопроцессами. Законы, описывающие изопроцессы, были открыты задолго до теоретического вывода уравнения состояния идеального газа. Изотермический процесс - процесс изменения состояния системы при постоянной температуре.
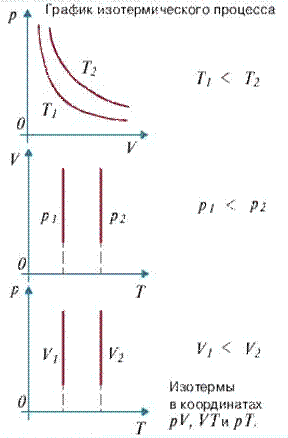
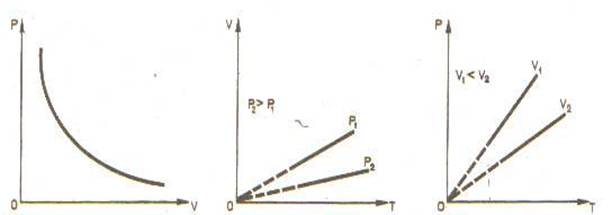
Для данной массы газа произведение давления газа на его объем постоянно, если температура газа не меняется. Это закон Бойля - Мариотта.
Для того, чтобы температура газа оставалась в процессе неизменной, необходимо, чтобы газ мог обмениваться теплотой с внешней большой системой - термостатом. Роль термостата может играть внешняя среда (воздух атмосферы). Согласно закону Бойля-Мариотта, давление газа обратно пропорционально его объему: $p_1V_1= p_2V_2=const$.Графическая зависимость давления газа от объема изображается в виде кривой (гиперболы), которая носит название изотермы. Разным температурам соответствуют разные изотермы.
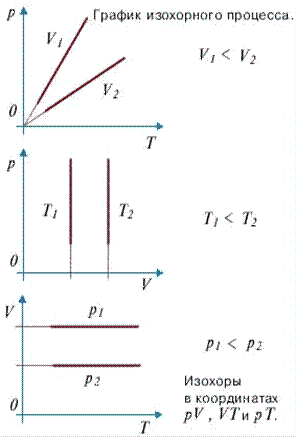
Изохорный процесс - процесс изменения состояния системы при постоянном объеме. Для данной массы газа отношение давления газа к его температуре остается постоянным, если объем газа не меняется. Этот газовый закон Шарля.
Согласно закону Шарля, давление газа прямо пропорционально его температуре: $\dfrac{p}{T}=const$.Или $\dfrac{p_1}{T_1} = \dfrac{p_2}{T_2}$. Графически эта зависимость в координатах $P-T$ изображается в виде прямой, выходящей из точки $T=0$. Эту прямую называют изохорой. Разным объемам соответствуют разные изохоры. Закон Шарля не соблюдается в области низких температур, близких и температуре сжижения (конденсации) газов.
Изобарный процесс - процесс изменения состояния системы при постоянном давлении. Для газа данной массы отношение объема газа к его температуре остается постоянным, если давление газа не меняется. Это закон Гей-Люссака.
Согласно закону Гей-Люссака, объем газа прямо пропорционален его температуре: $\dfrac{V}{T}=const$.Или $\dfrac{V_1}{T_1} = \dfrac{V_2}{T_2}$.
Графически эта зависимость в координатах $V-T$ изображается в виде прямой, выходящей из точки $T=0$. Эту прямую называют изобарой. Разным давлениям соответствуют разные изобары.
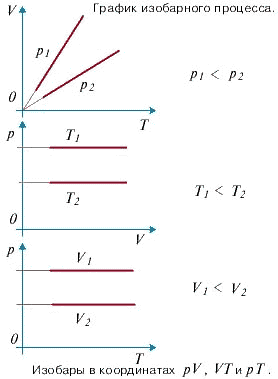
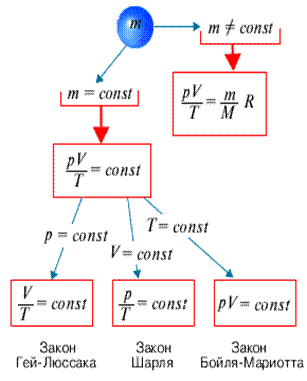
Закон Гей-Люссака, как и закон Шарля, не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов. Законы Бойля - Мариотта, Гей-Люссака и Шарля называют частными газовыми законами. Они являются частными случаями объединенного газового закона: Отношение произведения давления газа и объема к температуре для данной массы газа - величина постоянная: $\dfrac{pV}{T}$
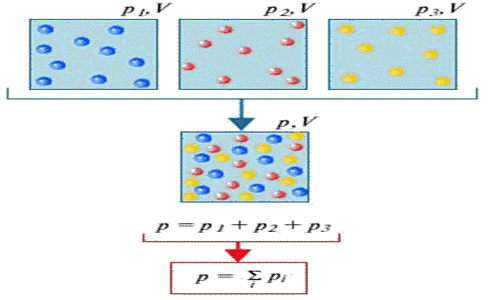
Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. Парциальное давление - это такое давление, которое производил бы газ, если бы он один занимал весь объем, равный объему смеси.
Между термодинамическими параметрами существует связь, даваемая уравнением состояния. Все достаточно разреженные газы (идеальные) подчиняются уравнению Менделеева - Клапейрона:
$pV=\dfrac{m}{M}RT$, где $p$ - давление, $V$ - объем, $m$ - масса газа, $M$ - молярная масса, $T$ - абсолютная температура, $R=8,31$ Дж/(моль$\cdot$К) - универсальная газовая постоянная.
Уравнение состояния содержит в себе в качестве частных случаев газовые законы, связывающие изменение двух термодинамических параметров при неизменном значении третьего. Для данной массы газа:
а) при $T=const \Rightarrow pV=const$ (закон Бойля - Мариотта);
б) при $p=const \Rightarrow \dfrac{V}{T}=const$ (закон Гей-Люссака)
в) при $V=const \Rightarrow \dfrac{p}{T}=const$ (закон Шарля).
О сайте|Разработчики
fizmatushki © 2019
e-mail:fizmatushki@yandex.ru